Biochemie – Enzymkinetik und Inhibierung
Enzyme sind die hochspezialisierten Biokatalysatoren lebender Zellen. Jedes Lebewesen kodiert hunderte dieser hochkomplexen Eiweißmoleküle in seiner DNA. Enzyme erhöhen die Reaktionsdauer einer chemischen Reaktion vom Substrat zum Produkt. Die Anwesenheit mancher Enzyme verkürzt die Reaktionszeit um den Faktor 107. Das entspricht dem Verkürzen der Wartezeit von einem Jahr auf eine Sekunde. Die Abwesenheit eines Enzyms kann die Ursache von Erbkrankheiten wie Hämophilie oder Lebensmittelunverträglichkeiten (z.B. Laktose-Intoleranz) sein.
Das Gebiet ‚Enzymkinetik und Inhibierung‘ ist Teil der biophysikalischen Chemie und beschäftigt sich mit der Funktionsweise und der Geschwindigkeit enzymkatalysierter chemischer Reaktionen. Man unterteilt Enzyme in sieben Klassen, welche sich von den chemischen Reaktionsmechanismen, die sie katalysieren, ableiten. Einige Unterklassen sind als Biokatalysatoren von industrieller Relevanz. Sie führen Reaktionsschritte in komplexen chemischen Synthesen effizienter und schneller durch als es chemischen Verfahren möglich ist. Wie Enzyme industriell entwickelt, hergestellt und angewendet werden, ist theoretischer und praktischer Bestandteil des Studiums der Industriellen Biotechnologie.
Das Quellen- und Literaturverzeichnis zu dieser Seite finden Sie hier.
Aufgabe 1 von 1
Ein beliebiges Enzym verhält sich – entsprechend der Michaelis-Menten-Kinetik – wie in Abb. 1 dargestellt. Die Reaktionsgeschwindigkeit wird hier in Abhängigkeit von der Substratkonzentration dargestellt. Mit zunehmender Substratkonzentration nähert sich die Enzymgeschwindigkeit der Maximalgeschwindigkeit vmax an. Der Km-Wert beschreibt die Substratkonzentration, die bei halber Maximalgeschwindigkeit des Enzyms vorliegt.
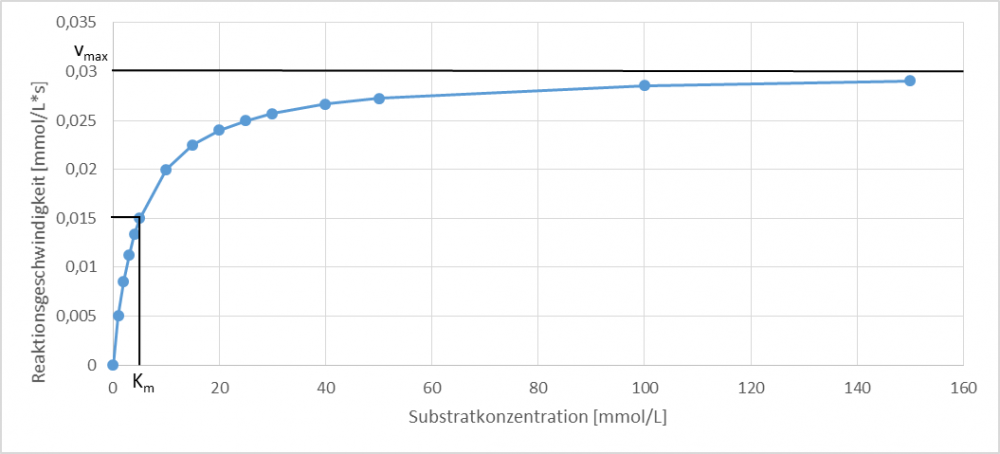
Grafik: HBC (2019)
Das Enzym kann durch verschiedene Inhibitoren beeinflusst werden. Das verändert die katalytische Geschwindigkeit und/oder den Km-Wert des Enzyms.
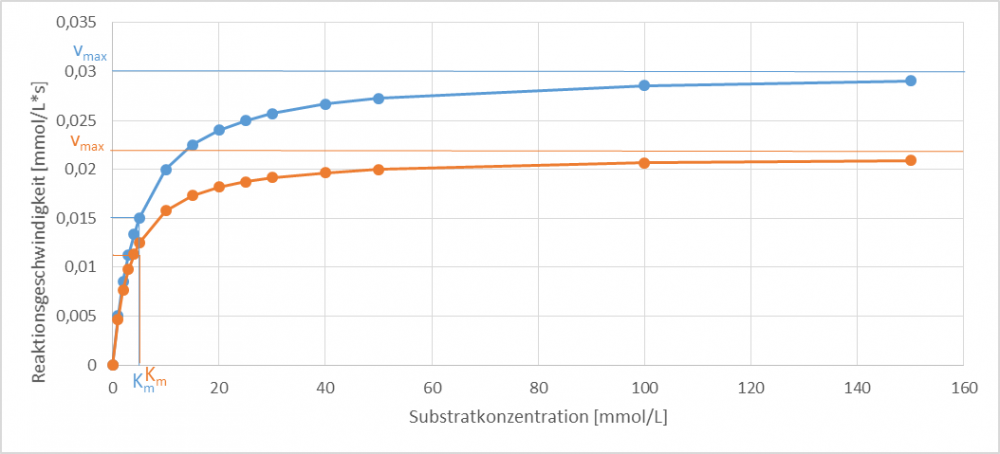
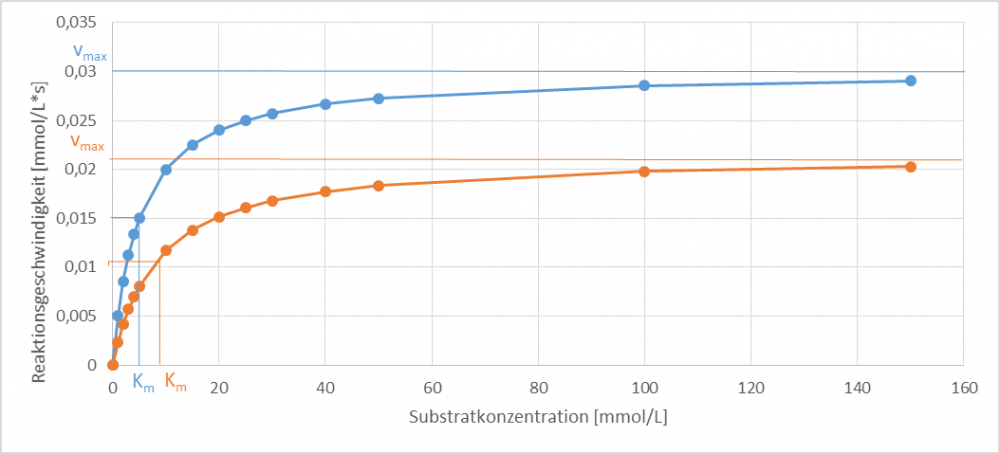
Ordnen Sie die Erläuterungen den, in Abb. 2-4 dargestellten, drei Inhibierungstypen (kompetitiv, unkompetitiv und nicht-kompetitiv) zu. Der orangene Graph zeigt jeweils das Verhalten des Enzyms mit Inhibitor und der blaue Graph zeigt jeweils das Verhalten des Enzyms ohne Inhibitor.
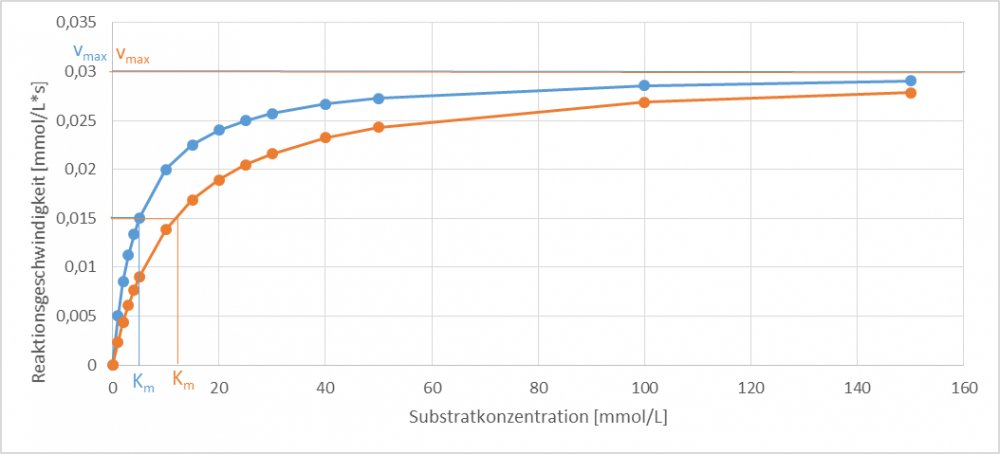
Bei der kompetitiven Hemmung bindet der Inhibitor an das freie Enzym und konkurriert dabei mit dem Substrat um die Bindestelle im aktiven Zentrum. Dies bedingt, dass die Reaktionsgeschwindigkeit sich erst bei höheren Substratkonzentrationen der Maximalgeschwindigkeit annähert, wodurch sich der Km-Wert erhöht.
Bei der unkompetitiven Hemmung bindet der Inhibitor an den Enzym-Substrat-Komplex und verhindert so die Bildung des Produktes. Dadurch verringert sich die Maximalgeschwindigkeit, während der Km-Wert gleich bleibt.
Die nicht-kompetitive Hemmung gehört zu der gemischten Hemmung. Dabei kann der Inhibitor sowohl an das freie Enzym als auch an den Enzym-Substrat-Komplex binden. Dadurch sinkt die Maximalgeschwindigkeit im Vergleich zur ungehemmten Reaktion, während der Km-Wert steigt.
1913 zeigten Leonor Michaelis und Maud Menten im praktischen Experiment den Zusammenhang von Substratkonzentration und Umsatzgeschwindigkeit. Seither haben Forscher*innen das Wissen um enzymkatalysierte chemische Reaktionen erweitert und es Ingenieur*innen, Naturwissenschaftler*innen und Mediziner*innen zugänglich gemacht. Heute füllen die 3D-Modelle von Proteinen und ihre Funktionsweise riesige Datenbanken. Ihre Anwendung erweitert sich zusehends und sie macht uns gesünder und unseren Alltag sauberer.
